
再生医療を臨床応用する場合、通常の医薬品と違い、生きている細胞を使用するため最終滅菌することができません。そこで培養などの細胞処理過程にGMP(good manufacturing practice)管理レベルと呼ばれる特定生物由来製品と同等の高度な無菌管理が必要となります。2009年5月にリサーチセンターB2クリーンルーム内にセルプロセッシング・アイソレータが導入され、GMP基準に準拠した細胞調製を可能とする細胞調製施設(Cell processing facility: CPF)が整備されました。
この施設は、平成20年度文部科学省私立大学戦略的研究基盤形成支援事業からの助成および細胞再生・移植医学分野、小児科学分野、整形外科学分野、循環器内科学分野、心臓血管外科学分野、泌尿器科学分野、腎臓高血圧内分泌内科分野の共同出資によって設立されたものです。
導入したパナソニック社製のセルプロセッシング・アイソレータ(AIS-H1400A)は、アイソレータ内のワークエリアを閉鎖系にし、過酸化水素蒸気を利用して除染することにより、グレードA(クラス100)の無菌操作が厳密に担保されるシステムです。閉鎖系アイソレータ内に遠心分離器や細胞観察用顕微鏡システムが内蔵されているため、大規模なクリーンルームを必要とすることなく、細胞操作、培養、観察といったすべての細胞処理行程を無菌環境下で行うことができます。
また個々の検体ごとに専用のインキュベータをアイソレータに連結して使用できるため、簡単に交差汚染が防止でき、多検体を連続的に処理することが可能です。
現在このセルプロセッシング・アイソレータを用いて、約5mlの吸引脂肪組織から脱分化脂肪細胞(DFAT)を無菌的に調製する作業手順の確立などの検討を行っています。
平成26年11月に施行された再生医療等安全性確保法では、細胞の培養・加工の安全性の確保という観点から、新たに細胞培養加工施設の構造設備の基準が制定されました。この新基準に適合した施設とするため、JST新産業創出プログラム(START)や日本大学学長特別研究などの助成を受け、CPFの再整備を行いました。本施設は平成28年11月にPMDAの施設調査を受け、平成29年2月に特定細胞加工物製造許可を得るに至っています。将来的には、多くの臨床科と共同でいろいろな細胞治療の可能性について検討し、臨床応用に活用していきたいと考えています。

パナソニック社製セルプロセッシング・アイソレータ(フード開放時)

フード閉鎖時(右上の部分が過酸化水素蒸気発生ユニット)
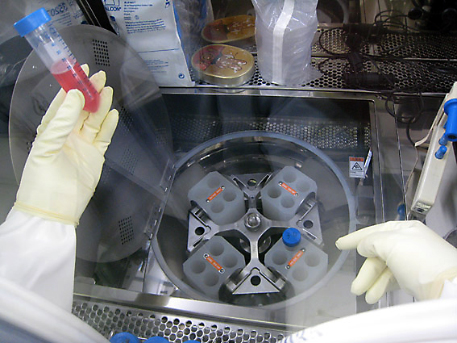
アイソレータ内に設置された遠心分離器

細胞培養用CO2インキュベータ(検体ごとに独立したインキュベータをアイソレータに連結して処理することにより厳密な交差汚染の防止が可能)

細胞加工作業の様子